当前较为普遍的精准治疗研究策略是找到癌症的病原基因,再依据癌症的病源不同对癌症进行精准分型,最后再进行针对性治疗设计或新药研发。这一研究模式已经有效地带来了73个已上市的精准靶向抗癌药物(World Cancer Res J, 2: e553)。这些靶向药物整体上能够有效改善特定突变类型的癌症患者的生存质量,是精准医学研究取得的重大成绩。但是这一策略也有一定的局限:癌症病因复杂,太多的基因变异都可能导致癌症。如按照基因变异的一致性将会把癌症病人分为太多的小类,每类仅有很少的患者,针对每类进行研究投入大、周期长、边际收益降低。迄今为止,按照这一模式研发的精准靶向药物,在国际大型研究项目的结果中,仅能覆盖2-6%的病例(Nature, 537: S63)。同时,精准地靶向癌组织的主效变异并不能解决肿瘤的异质性问题,反而容易造成肿瘤的克隆选择和变异复发。因此,很多研究也表明虽然靶向药物即期响应出色,但对于长期生存率的提升相当有限。正因为如此,2016年9月,两个顶级医学杂志连续发文探讨上述精准医疗策略的不足(Nature, 537: S63; New Engl J Med, 375: 1289)。我们可能需要另一套精准治疗的思路,作为现有策略的补充。
随着组学技术的发展,实验精度不断提高,成本不断降低,针对个体患者进行多组学疾病表征已经变得可行。同时,快速发展的个体化疾病模型技术,也使得药效的确认可以不再必须依赖真实的患者,而可以使用由患者发展而来的个体化癌症模型(如 PDX小鼠或者Organoid模型),利用这些模型针对个体疾病进行有效药物的筛选。
因此,我们遵循循证医学将指标与疗效关联起来的基本原则,提出按照下图的模式建立基于个体疾病组学表征的肿瘤个体化治疗方法。这一方法需要完成两个核心组成部分:一,病例库。病例库汇集过去积累的治疗经验,详细记录病例的疾病组学特征、药物响应、治疗进程。病例库中病例的用药响应和长期结局可以为新患者的治疗方案选择提供参考。当我们对于个体化疾病模型具有足够的了解时,就可以扩展病例库,将个体化疾病模型上的药物试验结果也认为是有效的“病例”,纳入病例库,为新患者的治疗方案选择提供参考。二,基于组学疾病表征的病例匹配方法。患者的疾病和对药物的响应本质上决定于患者的个体生理。组学数据,特别是转录组数据,是细胞生理状态的一个直接、系统、全面的反映。如果有足够准确的方法,能够依据不同患者的转录组数据判断他们对于特定药物响应的生理基础是否相似,则可以推测不同患者对于这一药物是否可能产生类似的响应。参考病例库中过去的患者对这一药物的响应数据,则可以对新的患者是否应该使用这一药物提供建议。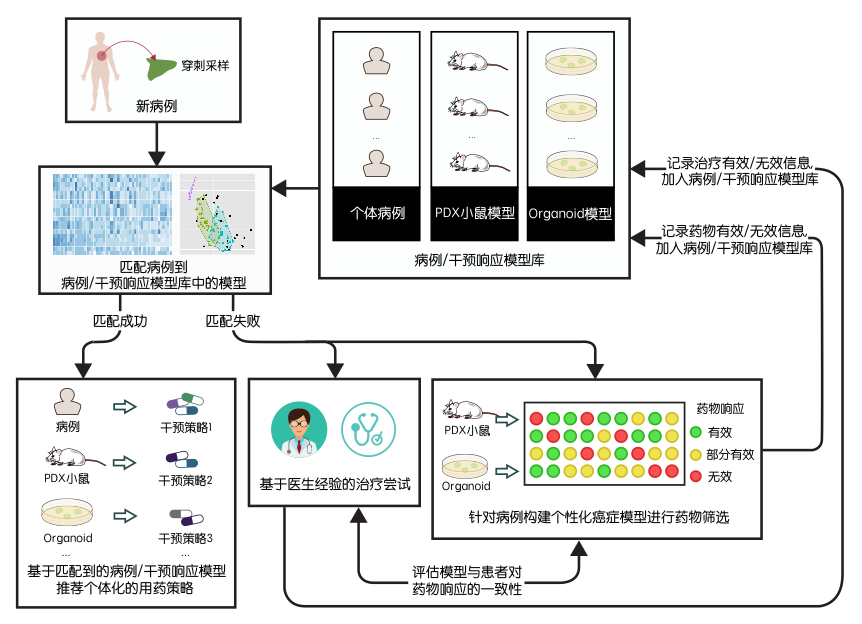
图1. 基于病例匹配的个体化精准治疗方法。
在当前的技术水平下,按照这一思路进行精准或个体化医疗的技术瓶颈在于病例匹配方法。整合生物学实验室建立的GSLA方法在细胞系转录组、组织器官转录组、表观遗传特征等不同类型的数据分析中,已经显示了其广泛适用的解析多基因协同改变导致生理功能变化的能力(阅读更多)。将GSLA方法应用于分析不同病例的用药前组学差异,评估这些差异的协同效应是否可能影响患者产生药物响应所需的生物途径或生理功能,即可能据此预测不同病例是否对于特定药物产生相同的响应。
当前整合生物学实验室的一项主要工作是建立个体病例的转录组特征与药物响应的对应关系基准数据集,并将GSLA发展成为一种可以依据病例间组学差异判断不同病例的药物响应是否一致的标准化分析工具,同时建立Organoid个体化肿瘤模型的培养和药效筛选流程,在以往的治疗经验无法为新病例提供治疗方案参考时,利用个体化肿瘤模型试验得到新病例的有效治疗方案。
在这一方向上,我们的合作团队包括(按拼音字母顺序排列):
郭勇健,明码生物(药明康德)数据分析部主任,CRO组学表征和质控。
凌志强,浙江省肿瘤医院研究所副所长,负责胃癌患者追踪。
许志忠,多伦多大学分子遗传学系教授,负责Organoid个体化肿瘤模型技术。
张兆雷,多伦多大学分子遗传学系教授,负责多组学联合疾病生理表征方法。
赵琼,浙医一院胸内科主任,中国医促会肿瘤内科分会副主任委员,负责肺癌患者追踪。